Identification des espèces chimiques
Introduction :
Les scientifiques ont appris à synthétiser des espèces chimiques intéressantes pour l’Homme et son industrie.
Ils savent également, depuis longtemps, extraire celles présentes à l’état naturel pour les exploiter à grande échelle. Voyons à présent quels critères physico-chimiques permettent d’identifier une espèce chimique, et donc de la reconnaître en l'analysant.
Pour cela, nous commencerons par voir quelques-unes des grandeurs caractéristiques des grandeurs chimiques que sont les températures de changement, la solubilité dans l’eau et la masse volumique. Puis, nous étudierons plus précisément une technique d’identification en laboratoire : la chromatographie sur couche mince.
Grandeurs caractéristiques d’une espèce chimique
Grandeurs caractéristiques d’une espèce chimique
Température de changement d’état
Température de changement d’état
Dans des conditions normales de température et de pression, chaque espèce chimique possède des propriétés physico-chimiques précises qui permettent de l’identifier.
Les conditions normales sont en fait des conditions de température et de pression atmosphérique arbitraires, qui servent de référence pour les mesures physiques :
- la température normale est 0 °C ;
- la pression normale est de 1 atm, autrement dit 1013,25 hPa.
Par « normal », il ne faut pas comprendre « classique » ou « habituel » mais bien « conforme à la norme sur laquelle les scientifiques s’accordent pour effectuer leurs relevés ». C’est pour cela que l’on parle de conditions arbitraires : elles n’ont rien de justifié dans la nature mais sont la convention en usage.
Par exemple, si en physique la température de condition normale est de 0 °C, en chimie, elle est généralement de 20 °C et la norme est précisée à chaque nouvelle expérience.
Par exemple, à pression atmosphérique normale, l’eau pure est :
- solide en dessous de 0 °C,
- liquide entre 0 et 100 °C,
- et gazeuse au delà de 100 °C.
Ces températures de changement d’état sont caractéristiques de l’eau : elles permettent de la reconnaître.
À titre de comparaison, l’azote, qui ressemble visuellement à l’eau est liquide en dessous de -195,79 °C, autrement dit à une température extrêmement basse, température à laquelle l’eau serait solide. Dans la nature, cet élément est en réalité le plus souvent présent à l’état gazeux : il s’agit de l’azote qui compose la majorité de notre atmosphère.
 Azote liquide
Azote liquide
On voit ainsi que les températures de changement d’état sont caractéristiques d’une espèce chimique donnée et que leur mesure permettent de l’identifier.
Une espèce chimique peut se trouver à l’état liquide, à l’état solide ou à l’état gazeux. Elle passe de l’un à l’autre en fonction de la température.
 Les changements d’état de la matière
Les changements d’état de la matière
Quelle que soit l’espèce chimique considérée, le passage d’un état à un autre porte toujours le même nom :
- le passage de l’état solide à l’état liquide, est la fusion ;
- le passage de l’état liquide à l’état solide est la solidification ;
- le passage de l’état liquide à l’état gazeux est la vaporisation, qui est visible durant la phase d’ébullition ;
- l’inverse de la vaporisation est la liquéfaction ;
- le passage instantané de l’état solide à l’état gazeux est appelé la sublimation ;
- le procédé inverse, la transformation d’un gaz en solide, est la condensation.
- La fusion, la vaporisation et la sublimation sont un passage d’un état plus froid à un état plus chaud de la matière : ces changements d’état absorbent de la chaleur.
- À l’inverse, la solidification, la liquéfaction et la condensation sont un passage de la matière à un état plus froid : ces changements dégagent de la chaleur.
Un changement d’état se fait à une température précise appelée température de changement d’état. Cette température dépend de la pression.
Les changements d’état intervenant le plus souvent dans la synthèse chimique sont la fusion et la vaporisation, qui ont lieu lors du chauffage, ainsi que la liquéfaction (ou condensation liquide), qui a lieu lors du passage dans le réfrigérant.
Connaître les températures de changement d’état des espèces chimiques aide à les identifier lorsqu’elles sont synthétisées en laboratoire. Mais on peut aussi mesurer leur masse volumique pour les identifier.
Masse volumique et densité d’une espèce chimique
Masse volumique et densité d’une espèce chimique
Chaque espèce chimique a une densité caractéristique.
Masse volumique :
La masse volumique $\rho$ d’un corps est égale au rapport de sa masse $m$ par son volume $V$. $$\rho =\dfrac{m}{V}$$ La masse volumique $\rho$ s’exprime en gramme par millilitre ($\text{g}\cdot\text{mL}^{-1}$), la masse $m$ est en gramme ($\text{g}$) et le volume $V$ est en millilitre ($\text{mL}$).
La masse volumique est souvent assimilée à la densité.
Densité :
La densité d’un corps par rapport à l’eau, notée $d$, est égale au rapport de sa masse volumique $\rho$ par celle de l’eau $\rho_{eau}$ : $$d=\dfrac{\rho}{\rho_{eau}}$$
Comme les masses volumiques ont la même unité, la densité n’en a pas.
Si densité et masse volumique sont souvent assimilées l’une à l’autre, c’est parce que la masse de l’eau est très proche de $1\ \text{g}\cdot\text{mL}^{-1}$. On considère donc très souvent que la densité d’un solide ou d’un liquide est égale à sa masse volumique. $$d=\rho$$
Solubilité d’une espèce chimique
Solubilité d’une espèce chimique
Solubilité :
La solubilité d’une espèce chimique dans un solvant correspond à la masse maximale d’espèce pouvant être dissoute dans 1 litre de solvant. La solubilité est notée $s$.
La masse $m$ est exprimée en gramme ($\text{g}$) et le volume de solution en litre ($\text{L}$). La solubilité s’exprime donc en gramme par litre ($\text{g}\cdot\text{mL}^{-1}$). Elle dépend de la température, de la pression et du type de solvant utilisé pour dissoudre l’espèce.
Par exemple la solubilité du sucre de table, le saccharose, dans l’eau à 20 °C, est de l’ordre de $2\ \text{g}\cdot\text{mL}^{-1}$ soit $2000\ \text{g}\cdot\text{L}^{-1}$.
- Cela signifie qu’on peut dissoudre au maximum 2 kg (ou 2 000 g) de sucre dans un litre d’eau. Si on essaie d’en dissoudre plus, le surplus restera sous forme solide au fond du récipient.
Chromatographie sur couche mince
Chromatographie sur couche mince
Principe
Principe
Chromatographie :
La chromatographie permet de séparer puis d’identifier les espèces chimiques d’un mélange d’espèces ou bien d’identifier une espèce chimique pure. Le nom complet de cette technique est la chromatographie sur couche mince, que l’on abrège parfois en CCM.
- Le mélange d’espèces chimiques à identifier est déposé sur une plaque chromatographique. Il s’agit en fait d’un papier très épais, assez souvent collé à un support en aluminium pour le rigidifier.
- La plaque est déposée verticalement dans un cristallisoir contenant un solvant appelé éluant. Seul le bas de la plaque est en contact avec l’éluant.
- Le front de l’éluant, c’est-à-dire la limite entre la partie mouillée et la partie sèche, remonte dans la plaque par capillarité et entraîne la substance chimique que l’on veut analyser.
 Photo d’une chromatographie
Photo d’une chromatographie
En chromatographie, la hauteur de migration dans la plaque est caractéristique pour chaque espèce chimique étudiée. Elle dépend de l’affinité de l’espèce avec l’éluant.
Le principe est qu’une espèce chimique migre de la même façon, qu’elle soit pure ou en mélange avec d’autres espèces chimiques. Autrement dit, lors de leur migration sur la plaque, les espèces chimiques vont aller plus ou moins loin selon leur degré de solubilité. Plusieurs tâches vont ainsi se créer sur le chemin de l’éluant.
Protocole de la chromatographie
Protocole de la chromatographie
Pour mieux comprendre, cherchons par exemple à déterminer la composition de la lavande par chromatographie sur couche mince.
- On prépare la manipulation : dans un bécher ou un cristallisoir suffisamment haut pour recevoir la plaque, on verse le solvant. Attention, il ne faut pas en mettre trop : l’éluant ne doit pas toucher la future ligne de dépôt. On place ensuite un couvercle et on attend que le milieu sature.
- Pendant ce temps, on prépare la plaque en y traçant une ligne de dépôt à environ 1 cm du bas. On y indique les points où l’on effectue les dépôts.
- On dépose en A quelques gouttes de lavande, en B du linanol et en C de l’acétate de linaline. Ces dépôts en B et C serviront à comparer les migrations des tâches du mélange A. On choisit les substances chimiques dont on soupçonne la présence dans le mélange analysé. La chromatographie est là pour valider ou invalider l’hypothèse de présence des composants B et C dans le mélange A. Les dépôts ne doivent pas excéder quelques gouttes afin d’être absorbés par la plaque et de ne pas couler lorsqu’elle est redressée.
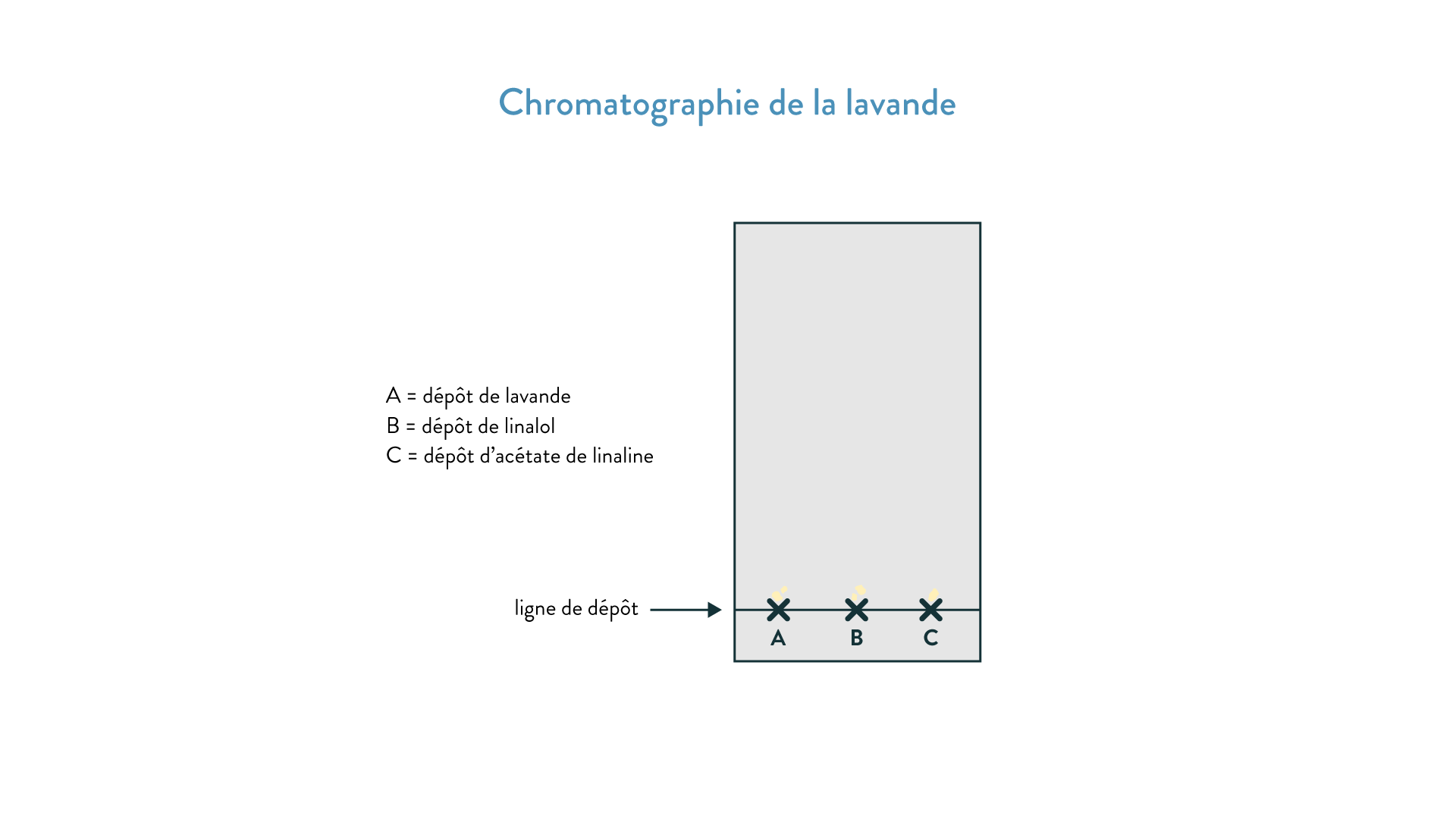
- On prend la plaque délicatement par les bords en évitant de toucher sa surface et on la place dans la cuve avant de refermer le couvercle. Il faut à présent attendre que l’éluant remonte.

- Lorsque le front de l’éluant est arrivé à environ 1 cm du haut, on retire la plaque de la cuve, on relève la hauteur de migration maximale atteinte et on laisse sécher. Le résultat est un chromatogramme qu’il faut alors analyser.
Analyse du chromatogramme
Analyse du chromatogramme

- Il apparaît clairement que la lavande A est constituée des espèces chimiques B et C puisqu’on retrouve dans la lavande les mêmes tâches que celles correspondant aux espèces B et C pures.
Pour identifier une espèce chimique présente dans un mélange, on mesure pour chaque tâche du chromatogramme deux distances (une espèce chimique correspondant à une tâche).
- On mesure d’une part la hauteur $h$ de migration de la tâche entre la ligne de dépôt et la tâche,
- et d’autre part la hauteur $H$ de migration de l’éluant (solvant) entre la ligne de dépôt et le front de l’éluant.
Ces mesures permettent de calculer le rapport frontal $R_f$ de chaque tâche du chromatogramme.
Rapport frontal en chromatographie :
En chromatographie, on calcule le rapport frontal en divisant la hauteur de migration de la tâche par la hauteur de migration de l’éluant. $$R_f=\dfrac{h}{H}$$
Le rapport frontal sera donc toujours inférieur à 1 : il est égal à 0,5 quand la migration a lieu en milieu de plaque.
Pour identifier les espèces chimiques présentes dans un mélange, on compare le rapport frontal $R_f$ de leurs tâches dans le mélange au rapport frontal $R_f$ des tâches correspondant aux espèces chimiques pures.
 Analyse du chromatogramme de la lavande
Analyse du chromatogramme de la lavande
- Le rapport frontal $R_f$ est caractéristique de chaque espèce chimique.





